Frühe Nutzenbewertung nach Arzneimittelmarktneuordnungsgesetz (AMNOG)
Frühe Nutzenbewertung nach Arzneimittelmarktneuordnungsgesetz (AMNOG)
Projektpartner: Universität Hamburg, Hamburg Center of Health Economics
Finanziert durch: Deutsche Forschungsgemeinschaft

Projektbeschreibung
(FI 1950/1-1 und STA 1311/1-1)
Hintergrund:
Für die pharmazeutische Industrie haben sich mit Verabschiedung des AMNOG im Jahr 2010 die Rahmenbedingungen für den Marktzugang patentgeschützter Arzneimittel stark verändert. Hersteller müssen innerhalb von drei Monaten nach Markteintritt beim Gemeinsamen Bundesausschuss ein Dossier einreichen, das den medizinischen Nutzen und Zusatznutzen im Vergleich zur Standardtherapie belegt. Abhängig von dem Ausgang der Nutzenbewertung kann der Hersteller im Anschluss mit dem GKV-Spitzenverband, der zentralen Interessensvertretung der Krankenkassen, in Preisverhandlungen treten oder unterliegt weiter gehender Regulierung. Ziel des Projektes ist es anhand der bestehenden Nutzenbewertungen seit Anfang 2011 Einflussfaktoren für die Bestimmung des Zusatznutzens sowie der Höhe des zu entrichtenden Rabattes auf den Herstellerabgabepreis zu identifizieren.
Ziel:
Daher wurden anhand der bestehenden Nutzenbewertungen seit Anfang 2011 und unter Verwendung von Regressionsverfahren Einflussfaktoren für die Bestimmung des Zusatznutzens sowie der Höhe des zu entrichtenden Rabattes identifiziert. Das im Antrag beschriebene Arbeitsprogramm wurde entsprechend umgesetzt. Unter Verwendung der AMNOG-Datenbank sind im Projektverlauf drei Forschungsarbeiten entstanden, die folgende Teilaspekte gemäß Arbeitsprogramm und darüber hinaus gehende Fragestellungen bearbeiteten:
1. Analyse von Effekten der Nutzenbewertung und / oder des Entscheidungsprozesses auf den Preis bzw. die Höhe des zu entrichtenden Rabattes
2. Frühe Nutzenbewertung nach AMNOG – Internationaler Vergleich mit Entscheidungen in England, Schottland und Australien
3. Einfluss der Bewertung über den Zusatznutzen neuer Wirkstoffe auf das Adoptionsverhalten durch Ärzte
Datenbank (DOI: 10.13140/RG.2.2.18391.16809)
Zur Untersuchung der Forschungsfragen war die zweifache Erhebung aller Entscheidungen nach AMNOG in Form einer Datenbank das zentrale Element des Projektes. Hierzu wurden im Projektverlauf alle seitens des G-BA abgeschlossenen Entscheidungen zwischen Januar 2011 und Dezember 2015 durch studentische Hilfskräfte erfasst. Die erhobenen Datenpunkte erfassen zu jedem bewerteten Wirkstoff Daten zu der vom Hersteller eingereichten Evidenz, die Entscheidung des G-BA sowie dessen Bewertung der Evidenz, die Bewertung des IQWIG, der Preisverhandlungen des GKV-Spitzenverbands sowie Informationen zu Arzneimittelpreisen gemäß Lauer-Taxe.
Insgesamt wurden 170 Entscheidungen zu 137 Wirkstoffen erfasst. Dies korrespondiert mit 215 Anwendungsgebieten und 527 Patientengruppen. Je Wirkstoff sind in der Regel mehrere Patientengruppen erfasst in potenziell unterschiedlichen Anwendungsgebieten, für die sich die Entscheidungsergebnisse unterscheiden. Zudem gibt es auf dieser Ebene Variation in der zur Verfügung stehenden Evidenz. Abbildung 1 zeigt die Verknüpfung der verschiedenen Ebenen:
Abbildung 1: erfasste Beobachtungsebenen der AMNOG-Datenbank
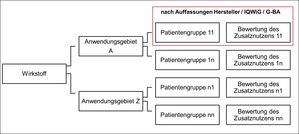
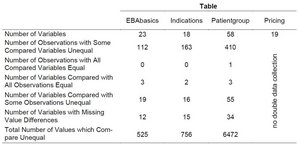
Tabelle 1: Abweichungen zwischen zwei Erhebungen der AMNOG-Nutzenbewertung
Die Datenbank ist auf Anfrage für wissenschaftliche Zwecke verwendbar.
Ergebnisse:
Für eine ausführliche Darstellung wird auf den Bericht an die DFG verwiesen.
- K E, Blankart; T, Stargardt: The impact of drug quality ratings from health technology assessments on the adoption of new drugs by physicians in Germany. In: Health Economics, Jg. 2020 (2020). doi:https://doi.org/10.1002/hec.4108
- Fischer KE, Heisser T, Stargardt T. Health benefit assessment of pharmaceuticals: An international comparison of decisions from Germany, England, Scotland and Australia. Health Policy. 2016 Oct;120(10):1115–22.; Verfügbar unter: http://www.sciencedirect.com/science/article/pii/S0168851016302044
- Lauenroth VD, Stargardt T. Pharmaceutical Pricing in Germany: How Is Value Determined within the Scope of AMNOG? Value in Health [online first: 18. Mai 2017]; Verfügbar unter: http://www.sciencedirect.com/science/article/pii/S1098301517302061
- Fischer KE, Peters K, Stargardt T. Information on product quality, change agency and product adoption. ACAD MANAGE PROC. 2017 Jan 1;2017(1):13580.; Verfügbar unter: http://proceedings.aom.org/content/2017/1/13580
- Fischer KE, Stargardt T (2014): Early Benefit Assessment of Pharmaceuticals in Germany Manufacturers’ Expectations versus the Federal Joint Committee’s Decisions. Med Decis Making. 34(8):1030–47.; Verfügbar unter: http://journals.sagepub.com/doi/abs/10.1177/0272989X14546377
